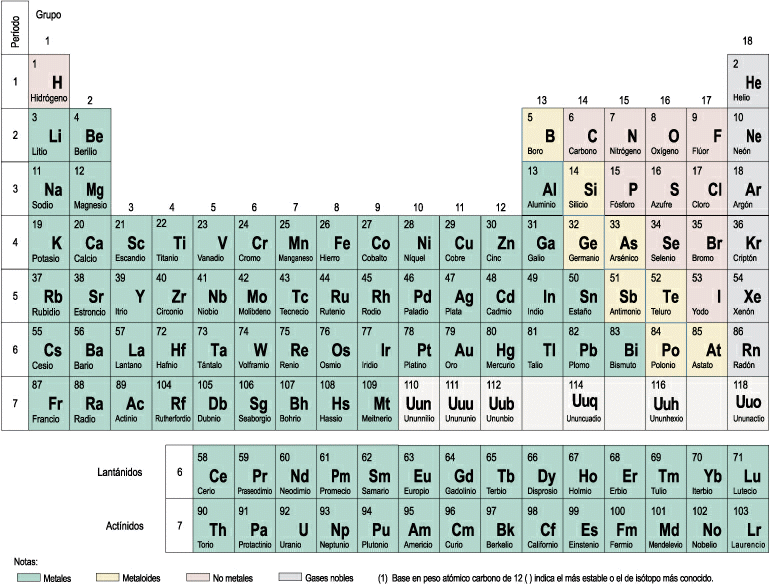
PROPIEDADES DE LA TABLA PERIÓDICA
Principales propiedades periódicas:
- RADIO ATÓMICO:
Es la distancia entre el centro del núcleo del átomo y el electrón estable más alejado del mismo.
ejemplo: un átomo tiene forma esférica, su radio es la mitad de la distancia entre los núcleos de dos átonos vecinos.
- En un periodo, su radio disminuywe de izquierda a derecha, por lo tanto su volumen sera menor.
- En ungrupo, se incrementa al aumentar el numero atomico.
2. ENERGIA DE IONIZACION:
Es la energia minima necesaria para quitar el electron mas externo a un atomo gase o gaseoso en estado neutro.
- la energia de ionizacion se expresa en kilojoules por mol.

3. CARACTER METALICO:
Se expresa en relacion a perder electrones o formar ionespositibvos,
llamados cationes.


4. AFINIDAD ELECTRONICA:
Es la energia liberada, cuando el atomo esta en estado gaseoso,
pues acepta un electron.
- En un periodo aumenta de izquierda a derecha.
- En un grupo aumenta de abajo hacia arriba.

5. ELECTRONEGATIVIDAD:
Sirve para atraer electrones de un atomo. Los diferentes valores de electronegatividad se clasifican según diferentes escalas, entre ellas la escala de Pauling y la escala de Mulliken.
Cuanto más pequeño es el radio atómico, mayor es la energía de ionización y mayor la electronegatividad y viceversa.